Zouten
Waar denk jij aan als je het woord ‘zouten’ hoort: de zoute zee of het zout dat je over je ei strooit? Als we zouten op een scheikundige manier gaan bekijken zit er wat meer achter dan je in de eerste instantie zou denken. Je leest er alles over in dit artikel!

Wat zijn zouten?

Zouten zijn chemische verbindingen tussen positieve en negatieve ionen. Hierbij zijn de positieve ionen vaak metalen en de negatieve ionen vaak niet-metalen.
Hoe ziet de structuur van zouten eruit?

Zouten bestaan uit ionen en zijn een samenstelling van een metaal en een niet-metaal. In de binding van zouten zijn de metalen vaak positief geladen en de niet-metalen vaak negatief geladen. Omdat deze positieve ionen en negatieve ionen elkaar aantrekken, ontstaat er een ionbinding.
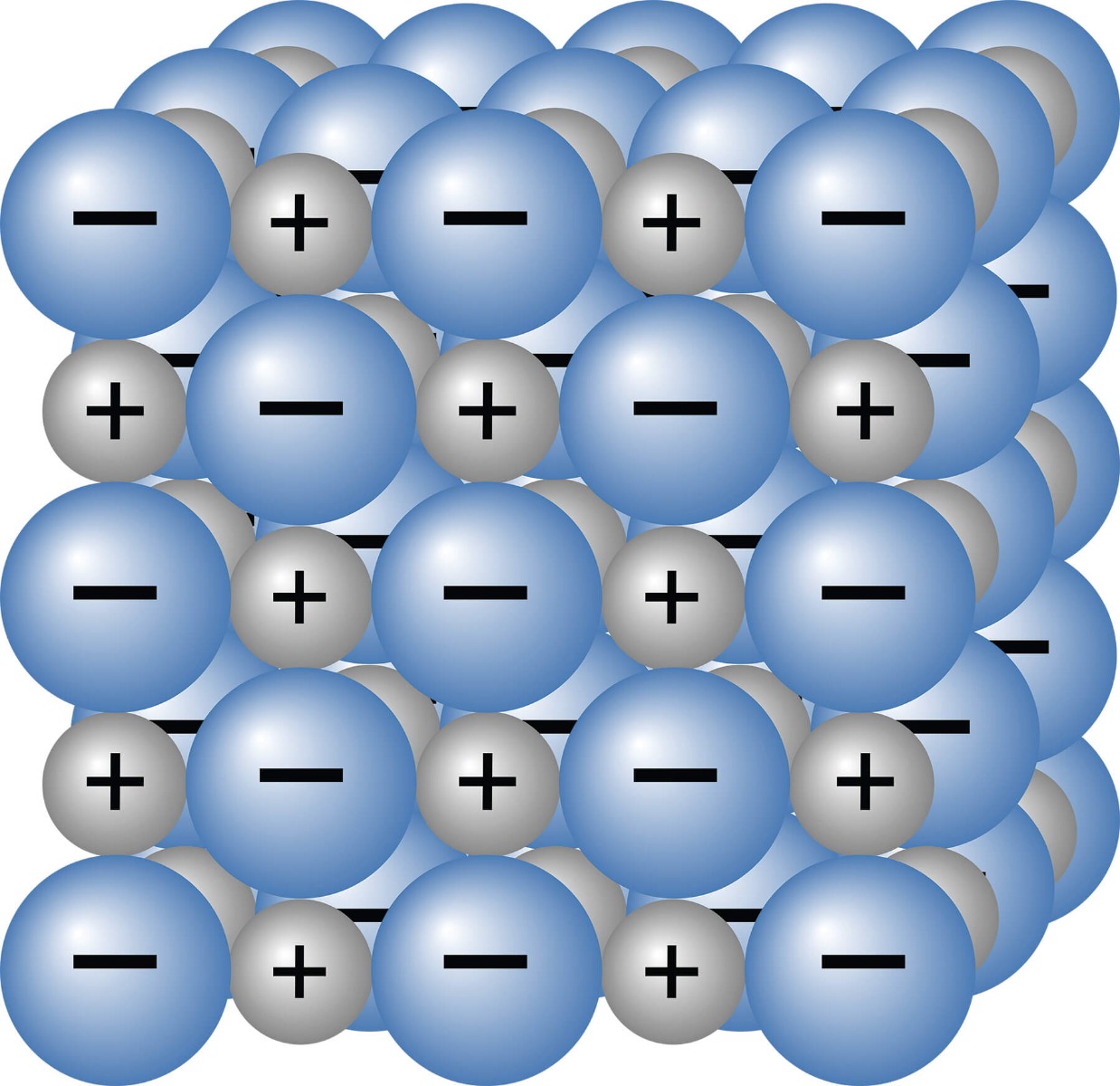
In vaste zouten zitten deze ionen in een bepaalde structuur, genaamd het ionrooster. Het rooster zorgt voor een sterke binding tussen de ionen, waardoor ze op hun plek blijven zitten. Dit kun je in de afbeelding hierboven goed zien. Omdat deze ionbindingen sterk zijn, hebben zouten over het algemeen een hoog smeltpunt. Daarnaast zou je verwachten dat zouten stroom kunnen geleiden, aangezien we te maken hebben met geladen deeltjes. Echter is het geleiden van stroom in vaste zouten niet mogelijk, omdat de ionen vast op hun plek zitten. Hierdoor kan lading in het rooster zich niet verplaatsen.
Opmerkelijk is dat er wel stroom doorheen kan lopen als zouten worden opgelost. Het verschil met vaste zouten is dat zodra je een vast zout oplost in een vloeistof (bijvoorbeeld water), de ionen los van elkaar in de vloeistof zweven. Het rooster zal dus uiteenvallen, waardoor de ionen zich nu wel kunnen verplaatsen.
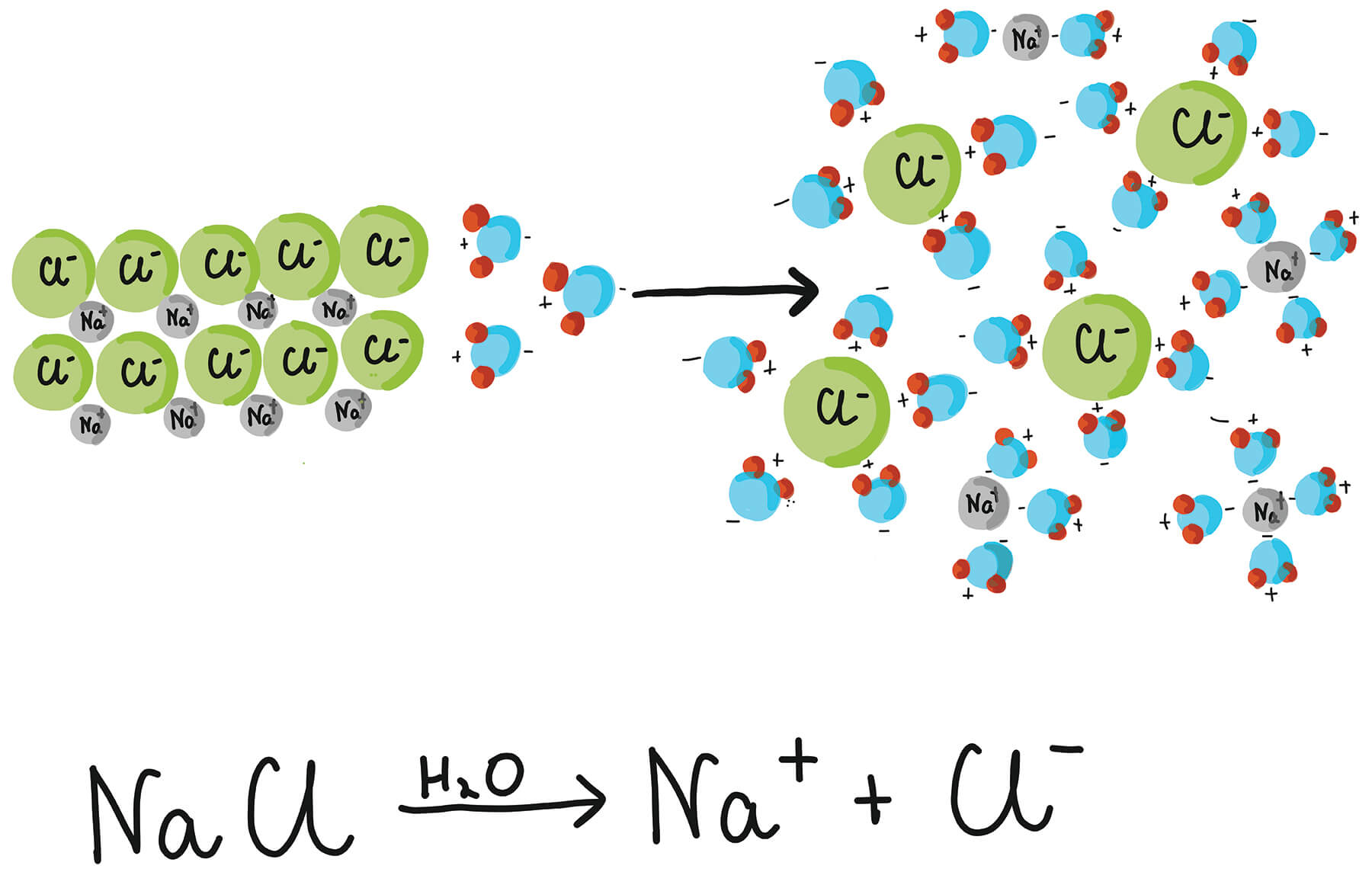
In deze afbeelding zie je een voorbeeld van een opgelost zout. In de eerste instantie heb je vast NaCl. Maar zodra je dit oplost in H2O zal het NaCl zich opsplitsen in de losse ionen Na+ en Cl-. Nu de ionen zich los kunnen verplaatsen, kan de lading zich via de ionen verplaatsen. Dit maakt stroomgeleiding mogelijk. Ook is te zien dat de watermoleculen om de ionen gaan zitten. Dit voorkomt dat de ionen weer een binding aangaan. Ze dienen dus als een beschermend dekentje.
Hoe reken je met molecuulformules en reactievergelijkingen van zouten?
Je kunt de losse ionen waaruit zouten bestaan vinden in Binas tabel 45A. Aan de linkerkant staan de positieve ionen en aan de bovenkant de negatieve ionen. Hieronder laten we wat voorbeelden zien.
Voorbeeld 1
Het zout Aluminiumchloride.
- Vind de bijbehorende losse ionen in Binas tabel 45A:
Al3+ en Cl-
- Stel de ladingen gelijk:
Al3+ : 3* Cl-
- Schrijf de losse ionen aan elkaar:
AlCl3
De niet-metalen kunnen ook als samengestelde ionen voorkomen. Een voorbeeld is NO3-. Het samenstellen van de molecuulformule gaat op dezelfde manier als bij enkelvoudige ionen. Echter zul je wat beter op de haakjes moeten letten om verwarring te voorkomen.
Voorbeeld 2
Het zout Aluminiumsulfaat.
- Vind de bijbehorende losse ionen in Binas tabel 45A:
Al3+ en SO42-
- Stel de ladingen gelijk:
2 * Al3+ : 3 * SO42-
- Schrijf de losse ionen aan elkaar:
Al2(SO4)3
Ontstaat er een neerslagreactie of lossen de ionen op?
Zouten kunnen goed of slecht oplossen in water. De onderstaande letters vertellen je daar meer over. Deze kun je vinden in Binas tabel 45A en geven aan wat er gebeurt als je deze ionen bij elkaar voegt:
- Een g geeft aan dat de zouten goed oplossen in water;
- Een m geeft aan dat de zouten matig oplossen in water;
- Een s geeft aan dat de zouten slecht oplossen in water;
- Een i geeft aan dat de zouten instabiel in water zijn;
- Een r geeft aan de zouten een reactie aangaan met het water.
Hieronder zie je hoe die ionen-reacties eruitzien in een reactievergelijking. Een goed oplosbaar zout zal van een vaste vorm opsplitsen in losse ionen. Dat komt doordat de waterdeeltjes dus om de losse ionen heen gaan zitten. De afkorting aq (Latijns: aqua = water) betekent dat het zout is opgelost in water.
AlCl3 (s) -> Al3+ (aq) + 3 Cl- (aq)
Een zout kan dus ook slecht oplossen in water. Hierbij zullen de ionen niet omringd worden door een dekentje van water en kunnen ze in het water bij elkaar komen. Hierdoor zal er een vaste stof worden gevormd, genaamd neerslag. De reactie noem je dan ook een neerslagreactie. Je geeft de vaste vorm aan met een s (solid = vast).
Al3+ (aq) + PO43- (aq) -> Al(PO4) (s)
Hieronder laten we met een voorbeeld zien hoe je van tevoren bepaalt of er een neerslagreactie zal ontstaan of dat de ionen zullen oplossen.
Voorbeeld
Stel je nu eens voor dat je in het lab onderzoek gaat doen waarbij je gebruikmaakt van verschillende zouten. Je wilt natriumchloride samenvoegen met zilvernitraat om te kijken wat er gebeurt. Zal er een neerslagreactie ontstaan of zullen de ionen oplossen? Hieronder is een stappenplan gegeven hoe je kunt bepalen wat er met de zouten gebeurt als je ze in water samenvoegt.
1. Schrijf alle losse ionen in de oplossing op:
- Natriumchloride: Na+ en Cl-
- Zilvernitraat: Ag+ en NO3-
2. Zoek de ionen op in Binas tabel 45A en bekijk alle mogelijke combinaties:
- Na+ + Cl- -> goed oplosbaar (g)
- Ag+ + NO3--> goed oplosbaar (g)
- Na+ + NO3--> goed oplosbaar (g)
- Ag+ + Cl--> slecht oplosbaar (s)
- Ag+ (aq) + Cl- (aq) -> AgCl (s)
- Na+(aq) + NO3-(aq) -> Na+ (aq) + NO3- (aq)
- Ag+ (aq) + Cl- (aq) + Na+(aq) + NO3-(aq) -> Na+ (aq) + NO3- (aq) + AgCl (s)
De deeltjes die niet veranderen hoef je niet in de reactievergelijking op te nemen. Dus je uiteindelijke reactievergelijking zal er als volgt uitzien:
- Ag+ (aq) + Cl- (aq) -> AgCl (s)
Waarom zijn zouten zo belangrijk voor ons?
Zouten zijn essentieel voor de mens. Het zit in je bloed, in je eten en in je drinken. Het zout dat wordt gebruikt in de keuken is keukenzout (NaCl). Dit is het meest voorkomende zout. Ook zitten er verschillende zouten in je bloed. Dit moet in balans worden gehouden om gezond te blijven. Als je bijvoorbeeld te veel zout eet, kan je hartslag verhogen. De zouten die hier vooral verantwoordelijk voor zijn, zijn natrium (Na+) en kalium (K+). Ze worden in balans gehouden door natrium/kalium pompen. De natriumconcentratie in je bloed ligt rond de 3 gram per liter.
Als het gesneeuwd heeft in de winter, kan het ijs voor gladde wegen zorgen. Om wegen ijsvrij te maken, wordt er gebruik gemaakt van enorme hoeveelheden zout. Dit zout noemt men strooizout. Het strooizout bestaat uit zouten die goed oplossen in water. Aangezien ijs eigenlijk een vorm van bevroren water is, zal het strooizout in het ijs oplossen. Er is nu eigenlijk een nieuwe samenstelling van water en zouten ontstaan, waardoor het vriespunt van het ijs daalt. Het ijs zal hierdoor smelten. De gemiddelde hoeveelheid strooizout die in Nederland wordt gebruikt ligt rond de 90 miljoen kilo per jaar!
Video
Bekijk onderstaande uitlegvideo van Scheikundelessen als je nog meer wilt weten over zouten:











