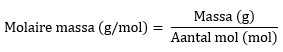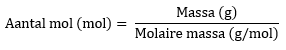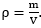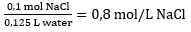De mol: wat is het en hoe reken je ermee?
Bij scheikunde heb je vaak te maken met moleculen en atomen. Om niet de tel kwijt te raken is de mol bedacht. We hebben het hier niet over degene die dat ene spelprogramma saboteert of die steenrijke mediamagnaat, maar over de scheikundige mol. Maar wat is deze mol precies? En hoe reken je ermee? In dit artikel kun je alles lezen over de mol.

Wat is een mol?

Een scheikundige werkt met hele kleine deeltjes, in de vorm van moleculen en atomen. Bij het doen van een reactie is het fijn om te weten met hoeveel moleculen van een stof je werkt. Omdat dit getal heel groot is, hebben scheikundigen een nieuwe eenheid bedacht: de ‘mol’.
De scheikundige mol is een eenheid die staat voor het aantal deeltjes, dus het aantal moleculen of atomen. Hierbij bevat 1 mol 6,022 × 1023 deeltjes, oftewel 6,022 × 1023 deeltjes per mol (mol-1). Dit getal wordt de constante van Avogadro genoemd en wordt aangeduid met het symbool NA.
Wil je wat meer verdieping over de mol? Check dan deze uitlegvideo van Scheikunde docent Sieger Kooij.
Molaire massa

Het gewicht van een atoom of molecuul wordt uitgedrukt in u, de atomaire massa-eenheid. Hierbij staat 1 u gelijk aan 1,66 × 10-27 kg. Een hele kleine massa dus! Om er makkelijker mee te kunnen rekenen, is de molaire massa bedacht. Deze massa geeft aan hoeveel gram een bepaalde stof weegt per 1 mol deeltjes van deze stof. Het handige is dat dit getal gelijk is aan de atoom- of molecuulmassa van één deeltje. Zo weegt 1 C-atoom gemiddeld 12,01 u, en weegt 1 mol C-atomen 12,01 g. Oftewel, de molaire massa van koolstof is 12,01 g/mol. De molaire massa (en dus ook de massa van één deeltje) kan je terugvinden in het periodiek systeem (tabel 99 van BINAS).
Rekenen met de molaire massa is heel simpel. De formule voor het berekenen van de molaire massa is:
Door deze formule om te schrijven, kan je het aantal mol berekenen als je de massa weet, namelijk:
Ook kan je berekenen wat de massa is van een stof als je weet hoeveel mol je hebt:
Rekenen met de mol en molaire massa
Met de mol kunnen veel dingen berekend worden, zoals het aantal aanwezige deeltjes, de massa van een aantal mol stof, het volume van een gas of de molariteit van een oplossing. Het is voor een scheikundige dus belangrijk om goed te kunnen rekenen met de mol. Maar hoe werkt dit precies? Hieronder geven we je een voorbeeld.
Stel, je hebt 48 gram methaan, CH4, en je wilt weten hoeveel mol dit is.
- Als eerste stap bereken je de molecuulmassa. De atoommassa van een koolstofatoom is 12,01 u. De atoommassa van een waterstofatoom is 1,008 u. Een methaan molecuul heeft dus een massa van 12,01 + 4 × 1,008 = 16,04 u.
- De molaire massa is gelijk aan de molecuulmassa van methaan. Oftewel, methaan heeft een molaire massa van 16,04 g/mol.
- Vervolgens schrijf je de formule voor molaire massa om, zodat er ‘het aantal mol =’ komt te staan:
- Door deze formule in te vullen, weet je hoeveel mol 48 gram methaan is.
Als de massa van een stof berekend is, kan het volume van deze stof berekend worden met behulp van T8, T9 of T10 in BINAS, waar zowel de dichtheid (ρ) van de stof gevonden kan worden als de formule
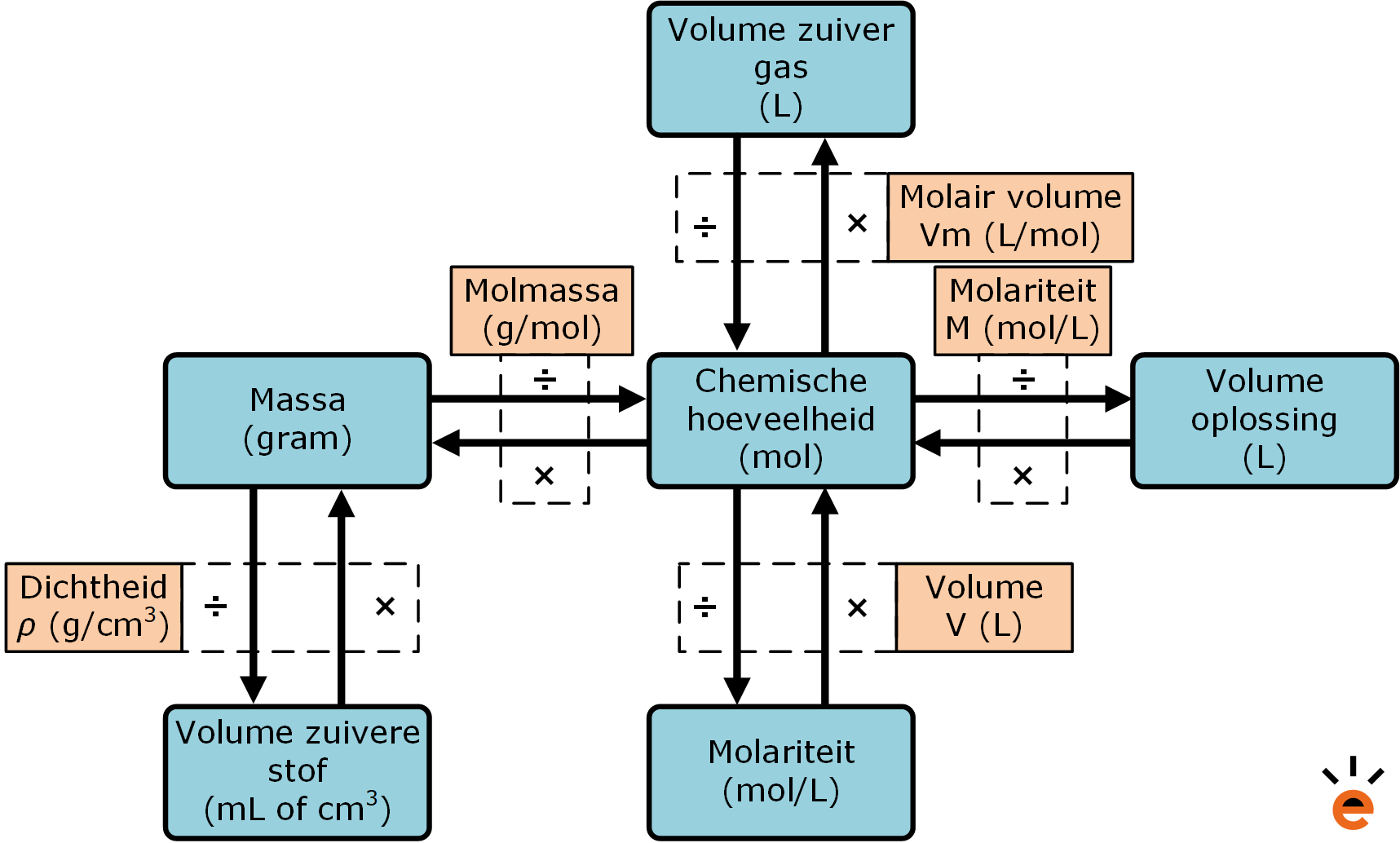
Bij het rekenen met de mol kun je verder gebruikmaken van onderstaand schema als je de mol moet omrekenen naar een andere eenheid.
Molair volume
Het molair volume is het volume van 1 mol ideaal gas bij een bepaalde temperatuur en druk. Met dit molair volume kan dus het volume van een bepaalde hoeveelheid mol gas of het aantal mol in een bepaald volume gas worden berekend.
Het molair volume bij 0 °C (273,15 K) en 1 atm druk is 22,41 L/mol.
Het molair volume bij 25 °C (298 K) en 1 atm druk is 24,5 L/mol.
Deze waarden zijn ook terug te vinden in BINAS T7.
Voorbeeld:
In een ruimte bevindt zich 3 L Cl2 gas, wat zich ideaal gedraagt. Bij 298 K en 1 atm, hoeveel mol Cl2 gas is dit?
- Het molair volume bij 298 K en 1 atm is 24,5 L/mol.
- Om te berekenen hoeveel mol Cl2 gas er is, moet 3 L dus gedeeld worden door 24,5 L/mol.
0,122 mol Cl2 gas.
Molariteit
Als een stof zich in oplossing bevindt, heeft deze stof een concentratie. Deze concentratie kan in g/L gegeven worden, maar ook in mol/L. Een concentratie in mol/L geven is vaak handiger tijdens het doen van reacties, want dan weet je meteen hoeveel deeltjes van de opgeloste stof er in een liter zitten. Als het aantal mol van de opgeloste stof bekend is, kan de molariteit van een oplossing makkelijk berekend worden door te delen door het volume.
Voorbeeld: 0,1 mol NaCl wordt opgelost in 0,125 L water. Wat is de molariteit van deze oplossing?
- Het aantal mol NaCl moet gedeeld worden door het volume waar het in is opgelost om de molariteit te berekenen.
Daarnaast kun je ook de molariteit berekenen als er al een concentratie in g/L bekend is, door de molaire massa van de stof te gebruiken.
De mol in een reactievergelijking
De mol is niet alleen handig tijdens het rekenen, maar ook tijdens het begrijpen van reactievergelijkingen.
Voorbeeld:
In deze reactievergelijking staan er soms cijfers voor de molecuulformule. Deze cijfers heten coëfficiënten en zorgen ervoor dat de reactievergelijking klopt. Deze coëfficiënten geven geen ware hoeveelheden aan, maar eerder de ratio waarin deze stoffen reageren. Als het ware staat er nu:
1 deel zuurstof reageert met 2 delen waterstof tot 2 delen water.
Dit wordt ook wel de molverhouding genoemd, aangezien dit ook gelezen kan worden als:
1 mol zuurstof reageert met 2 mol waterstof tot 2 mol water.
De molverhouding wordt dan als volgt opgeschreven: O2:H2:H2O = 1:2:2.
Video
Meer uitleg over het rekenen met de mol vind je onderstaande video van scheikundeleraar Sieger Kooij.