Alles over chemische bindingen
Chemische bindingen, je hebt er vast al eens van gehoord. Maar wat doen deze bindingen precies en welke soorten zijn er? In dit artikel lees je alles wat je moet weten over chemische bindingen.

Wat is een chemische binding?
Een chemische binding is een binding tussen twee of meer atomen, ionen of moleculen. Hierdoor blijven de deeltjes in moleculen, vaste stoffen en vloeistoffen bij elkaar.
Soorten bindingen
Er zijn verschillende soorten chemische bindingen, welke afhankelijk zijn van de soort stof. Hierbij wordt een onderscheid gemaakt tussen moleculaire stoffen, zouten en metalen.
Moleculaire stoffen

Atoombinding
Een atoombinding is een binding tussen niet-metaal atomen. Het wordt ook wel een covalente binding genoemd. Bij een atoombinding worden de atomen aan elkaar gebonden door een zogenaamd gemeenschappelijk elektronenpaar. Hierbij dragen beide atomen 1 valentie-elektron bij aan de binding. Deze valentie-elektronen bevinden zich altijd in de buitenste elektronenschil van het atoom. Het aantal valentie elektronen is ook bepalend voor de covalentie van het atoom. Meestal heeft een atoom in een molecuul maar 1 atoombinding met een ander molecuul, maar dubbele bindingen komen ook voor, zoals tussen de koolstoffen in etheen (C2H2).
Polaire atoombinding
Bij een polaire atoombinding delen twee atomen een gemeenschappelijk elektronenpaar. Het is bijna hetzelfde als een atoombinding. Het verschil met een gewone atoombinding is dat in een polaire atoombinding het ene atoom net iets harder aan de gemeenschappelijke elektronen trekt dan het andere atoom. Daardoor wordt het harder trekkende atoom net iets negatiever geladen, en het minst hard trekkende atoom iets positiever. Dit komt omdat het elektronenpaar zich niet meer exact in het midden van de twee atomen bevindt. Een voorbeeld hiervan is een watermolecuul (H2O). Hierin trekt het zuurstofatoom net iets harder aan de elektronenparen, waardoor deze een wat negatievere lading krijgt en de waterstofatomen een positievere lading. Dit kunnen we in de molecuulstructuur aangeven met een δ- en een δ+. Als deze ladingen asymmetrisch over het molecuul verdeeld zijn dan spreken we van een dipool.
Vanderwaalsbinding
De vanderwaalsbinding is een zwakke binding tussen moleculen, in plaats van atomen. Tussen grotere moleculen zijn de vanderwaalsbindingen groter dan tussen kleinere moleculen. De sterkte van de binding hangt dus af van de grootte van het molecuul. Hierbij gaat het vooral om de molecuulmassa: grotere moleculen wegen meer, en trekken elkaar dus sterker aan. Omdat de vanderwaalsbinding gaat om interacties tussen moleculen, hangt het kookpunt van een stof vaak af van de vanderwaalsbindingen. Let hierbij wel goed op, want er kunnen ook nog andere interacties meespelen (zoals waterstofbruggen).
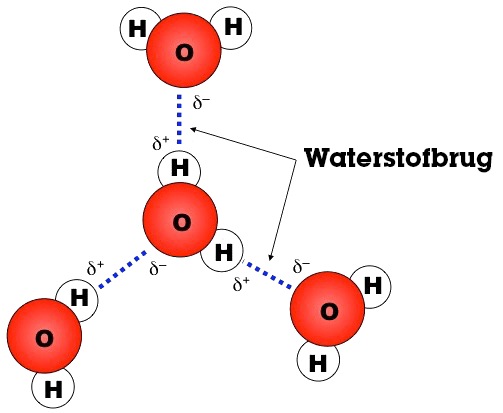
Waterstofbrug
Een waterstofbrug is een binding tussen bepaalde groepen in een molecuul. Deze binding kan voorkomen tussen verschillende moleculen, maar ook binnen een groot molecuul zoals een eiwit. Meestal wordt de waterstofbrug gevormd tussen -OH groepen. Wat er dan gebeurt is dat het H-atoom (wat een beetje positief geladen is) in de -OH groep wordt aangetrokken door het O-atoom (wat een beetje negatief geladen is) van de andere -OH groep. Deze binding is relatief sterk, vandaar ook dat water een hoog kookpunt heeft voor zo’n klein molecuul. Waterstofbruggen spelen ook een belangrijke rol bij hydrofiele en hydrofobe stoffen. Let op: een waterstofbrug is geen covalente binding, maar gebaseerd op elektrostatische interacties.
Dipool-dipoolinteracties
Als moleculen polaire bindingen hebben die asymmetrisch over het molecuul verdeeld zijn, dan noemen we het een dipool. Dit betekent dat verschillende kanten van het molecuul verschillende ladingen hebben. Als je meer van deze moleculen in een oplossing hebt, dan trekken de negatief geladen kant van het ene molecuul en de positief geladen kant van het andere molecuul elkaar aan. Dit noemen we dipool-dipool interactie.

Zouten

Ionbinding
Zouten bestaan uit een combinatie van een metaal en een niet-metaal ion, waarbij het metaal altijd positief geladen is en het niet-metaal de negatieve lading draagt. Zoutmoleculen zijn op zichzelf ongeladen, omdat de negatieve lading van het niet-metaal de positieve lading van het metaal compenseert en andersom. Tussen de twee ionen bevindt zich de ionbinding, welke voortkomt uit de sterke elektrostatische interacties tussen de atomen. Ionbindingen zijn erg sterk. Zo vormen zij in zouten in vaste vorm een kristalstructuur.
Metalen
Metaalbinding
Bij metalen spreken we eigenlijk altijd van een metaalrooster (in vaste vorm). Dit rooster bestaat uit positief geladen metaalionen die de elektronen van hun buitenste schil zijn verloren. Deze elektronen kunnen nu vrij rondspringen in het rooster, en houden hiermee de positief geladen metaalionen bij elkaar. Doordat de elektronen vrij kunnen rondspringen door het metaalrooster geleiden metalen stroom.
Wat is een dubbele binding?
We spreken van een dubbele binding als twee atomen door niet 1, maar 2 covalente bindingen aan elkaar zitten. Dit is bijvoorbeeld het geval in een etheenmolecuul, maar ook in onverzadigde vetten. Twee atomen kunnen ook met drie covalente bindingen aan elkaar gekoppeld zitten. We spreken dan van een drievoudige binding. Een voorbeeld hiervan is ethyn.
Wat is covalentie?
Covalentie zegt iets over hoeveel bindingen een atoom aan kan gaan. In het plaatje hieronder zie je een methaan molecuul (CH4). Hier heeft waterstof (H) een covalentie van 1 en koolstof (C) een covalentie van 4. Dit betekent dat waterstof zich aan 1 ander atoom kan binden en koolstof aan 4 andere atomen. Dit betekent ook dat het koolstofatoom in onderstaand plaatje (CH4) altijd in het midden moet staan, omdat H zich maar aan 1 atoom kan binden.
Let op: als atomen een lading hebben, dan kan het aantal bindingen afwijken van het aantal valentie elektronen!
Hoe teken je een atoombinding?
Atoombindingen tekenen we in molecuultekeningen altijd met een streepje. Zo wordt de binding tussen twee waterstofatomen (H2) bijvoorbeeld weergegeven als H-H. Je hebt echter ook complexere moleculen. In het plaatje hieronder zie je bijvoorbeeld een etheen molecuul. Deze heeft een dubbele binding en wordt dus getekend met een dubbel streepje. Denk er dus ook over na dat hier per atoom niet 1, maar 2 valentie-elektronen voor nodig zijn! Als je niet zeker weet of je een structuur goed hebt getekend, is het dus altijd nuttig om het aantal bindingen rondom een atoom te tellen en dat te vergelijken met de covalentie van het atoom.















